Zázrak medicíny prešiel do nového levelu. Na miešanie génov už nepotrebujeme vírusy
O revolučnej technológii CRISPR-Cas9, slúžiacej na úpravu génov, si zrejme už počul. Ľudstvo má v rukách CRISPR len približne jednu dekádu a Nobelovu cenu zabezpečila v roku 2020, takže sa naďalej jedná o veľmi mladú technológiu, ktorá potrebuje dodatočný výskum, experimenty a skúšky.
Značné vylepšenie
Najnovší výskum publikovaný v žurnále Nature Biotechnology posunul editáciu génov CRISPR do nového levelu. Výskumníci totiž obajvili spôsob, ako zlepšiť úpravu nevírusových génov, ako aj nový typ opravy DNA. Na tému upozornil portál NewAtlas.
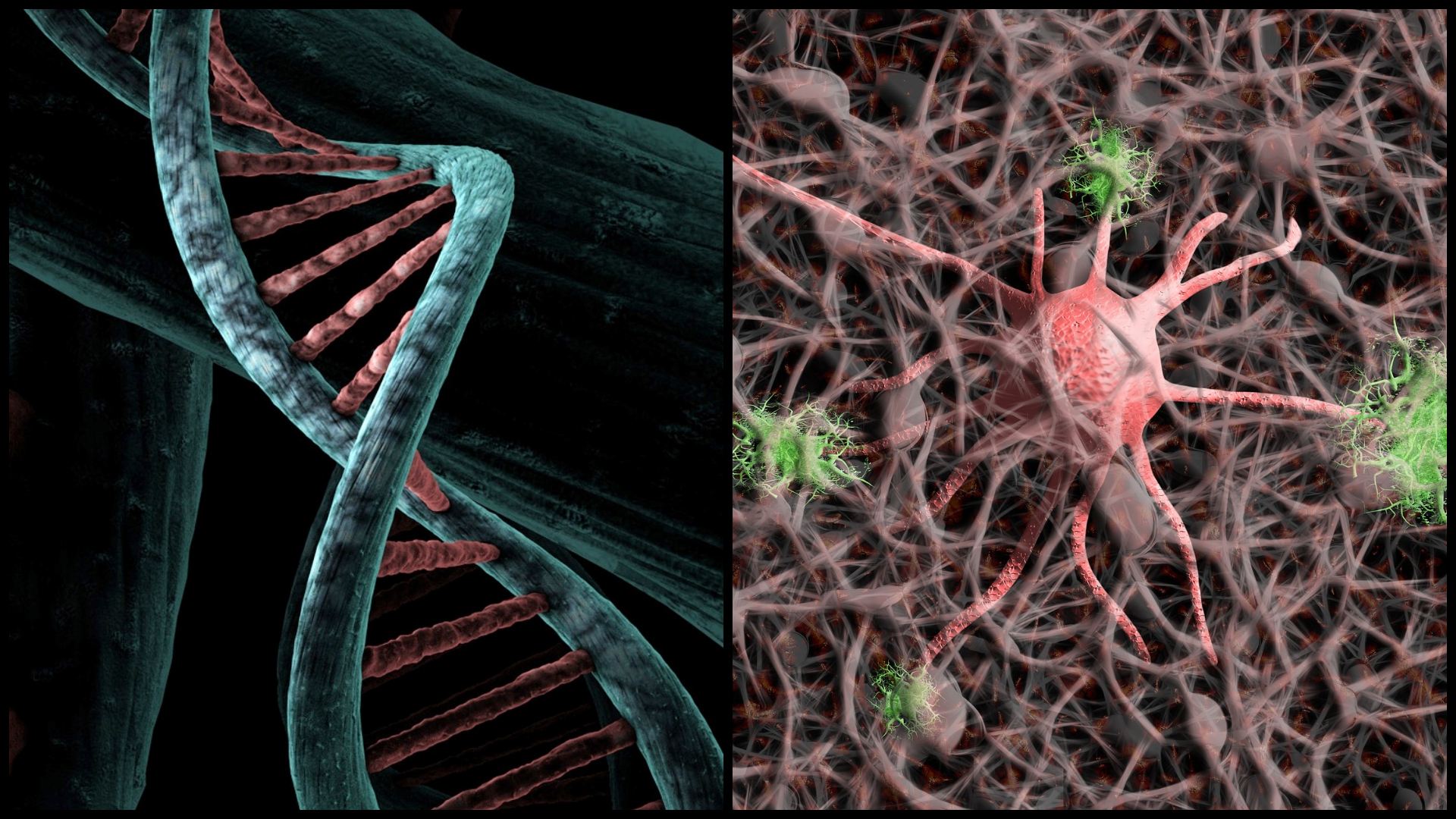
Presnejšie sa vedcom z univerzity Santa Barbara podarilo zvýšiť efektivitu CRISPR-Cas9 bez použitia vírusového materiálu potrebného na dodanie genetickej šablóny (templátovej DNA) použitej na úpravu cieľovej genetickej sekvencie, uvádza sa v tlačovej správe univerzity.
Na čom je založená metóda CRISPR?
CRISPR je fascinujúca skupina genetických sekvencií, ktoré sa nachádzajú v genómoch prokaryotických organizmov, ako napríklad baktérie a archeóny.
Tieto sekvencie, známe ako CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), tvoria neodmysliteľnú súčasť genómov mnohých živých organizmov, vrátane baktérií. Ich hlavnou funkciou je uchovávať informácie o predošlých vírusových infekciách.
Keď sa organizmus stane obeťou vírusovej infekcie, CRISPR sekvencie zachytia a zapamätajú si malé úseky DNA vírusu. Tieto zapamätané sekvencie sú neskôr využité na identifikáciu a odstránenie vírusovej DNA v prípade, že organizmus znova čelí infekcii.
Túto úlohu zohráva špeciálny proteín nazývaný Cas9, ktorý slúži ako molekulárne „nožnice“ schopné rezať DNA. Pri vírusovej infekcii baktérií sa časť DNA vírusu „odreže“ a vloží sa do vlastnej DNA baktérie v oblasti známej ako CRISPR pole. To znamená, že ak sa baktéria znovu infikuje, dokáže tento vírus rozpoznať a zničiť ho.
V podstate CRISPR-Cas9 metóda využíva prirodzený obranný systém baktérií proti vírusom prostredníctvom rozpoznávania a odstraňovania vírusovej DNA.

Homologicky riadená oprava
Tento „rez“ je tiež príležitosťou na nahradenie oddelených génov podobnými (homologickými), ale vylepšenými génmi s využitím prirodzených opravných mechanizmov bunky. V prípade úspechu má potom bunka výrazne upravené funkcie. Niečo takéto odborníci označujú termínom homologicky riadená oprava.
Treba tiež poznamenať, že najčastejšie sa na dodanie opravnej (templátovej) DNA do jadra používajú vírusy. Výskumníci tvrdia, že hoci sú tieto metódy účinné, takýto „vírusový postup“ je drahý, ťažko škálovateľný a potenciálne toxický pre bunky.
V tomto prípade sa templátová DNA využíva na vloženie špecifických sekvencií do cieľovej DNA. Táto templátová DNA obsahuje požadované sekvencie, ktoré majú nahradiť časti DNA, ktoré boli odstránené pomocou enzýmu Cas9.
Nevírusový systém
Najnovšie sa však výskumníkom z UC Santa Barbara podarilo vyvinúť špeciálny nevírusový aplikačný systém, ktorý zvyšuje účinnosť CRISPR-Cas9 na úpravu génov a tiež výrazne zlepšuje homologicky riadenú opravu. Takéto nevírusové „templáty“ sú potenciálne lacnejšie a škálovateľnejšie.

Taktiež sa ukázalo, že zavedenie ICL (Interstrand crosslinks) mnohonásobne zvyšuje efektivitu homologicky riadenej opravy. ICL sú v podstate vysoko toxické lézie DNA, ktoré bránia rozpletaniu vlákien DNA a blokujú pohyb replikačného aparátu a enzýmov zapojených do transkripcie (proces, pri ktorom sa genetická informácia obsiahnutá v DNA prepisuje do poradia nukleotidov v RNA). To vedie k poruche správneho fungovania bunky.
Tento princíp sa využíva napríklad pri chemoterapii, na prerušenie rastu nádorových buniek.
Ukázalo sa však, že pridanie ICL k homologicky riadenej oprave stimuluje prirodzené opravné mechanizmy bunky, čím sa zvyšuje pravdepodobnosť úspechu úpravy.
„V podstate sme urobili to, že sme vzali templátovú DNA a poškodili ju,“ uvádzajú vedci. „V skutočnosti sme ju poškodili tým najvážnejším spôsobom, aký si dokážem predstaviť.“
Bunka však namiesto toho, aby túto úpravu považovala za odpad, ktorý je potrebný vyhodiť, ju vložila do svojho genómu. Vedci veria, že ich metóda nájde svoje uplatnene v oblasti výskumu chorôb a predklinických prácach.
„Môžeme efektívnejšie poraziť gény a vložiť určité veci do genómov, aby sme mohli študovať systémy mimo ľudského teľa v laboratórnom prostredí,“ uvádzajú vedci.
Štúdia tiež prispeje k efektívnejšiemu vytváraniu modelov rôznych chorôb a a tiež k testom hypotéz o tom, ako tieto choroby fungujú.
Ďakujeme, že čítaš Fontech. V prípade, že máš postreh alebo si našiel v článku chybu, napíš nám na redakcia@fontech.sk.
Teraz čítajú

USA ani Rusko nemajú šancu. Čína chce na Mesiaci urobiť niečo, čo ešte nikto nedokázal

Žiadne rakety, do vesmíru nás dostanú solárne krídla. Ukázali novú družicu s revolučným pohonom

Vedci namierili Webbov teleskop na blízku planétu. Je až 50 % šanca, že tam nájdu život

Legendárne observatórium našlo stratenú planétu. Jedna vec na nej vôbec nesedí

Prelom: Vedci prvýkrát umelo vytvorili čiernu dieru. Padli im sánky, keď začala žiariť
- 24 hod
- 48 hod
- 7 dní
-
- Veľký deň pre ľudstvo: NASA zachytila zašifrovanú správu z hlbokého vesmíru
- Odhalili desiatky podvodných e-shopov na Slovensku. Vyskúšali sme ich a neverili vlastným očiam (+zoznam)
- EÚ stráca trpezlivosť. Obľúbenej sociálnej sieti Slovákov hrozí zákaz
- Prelom: Vedci prvýkrát umelo vytvorili čiernu dieru. Padli im sánky, keď začala žiariť
- Vedci rozlúštili 2000-ročný papyrus. Ukrýval odpoveď na jednu z najväčších otázok
-
- Veľký deň pre ľudstvo: NASA zachytila zašifrovanú správu z hlbokého vesmíru
- Odhalili desiatky podvodných e-shopov na Slovensku. Vyskúšali sme ich a neverili vlastným očiam (+zoznam)
- EÚ stráca trpezlivosť. Obľúbenej sociálnej sieti Slovákov hrozí zákaz
- Prelom: Vedci prvýkrát umelo vytvorili čiernu dieru. Padli im sánky, keď začala žiariť
- Vedci rozlúštili 2000-ročný papyrus. Ukrýval odpoveď na jednu z najväčších otázok
-
- Veľký deň pre ľudstvo: NASA zachytila zašifrovanú správu z hlbokého vesmíru
- Veľký elektropredajca na Slovensku končí. Toto bude jeho náhrada
- Apple to dokázal. Na iPhone príde zmena, po ktorej už žiadny Android nebude dávať zmysel
- Prelom: Vedci prvýkrát umelo vytvorili čiernu dieru. Padli im sánky, keď začala žiariť
- Zem má druhý mesiac, vieme odkiaľ pochádza. Odhalil ho gigantický kráter
O hlasovací preukaz v eurovoľbách možno požiadať aj cez aplikáciu Voľby.Digital
Podľa novej štúdie môže pacientom s Alzheimerom pomôcť rapamycín
Batman sa vracia na nečakanej platforme. Sleduj temný trailer
Ruský plynárenský koncern Gazprom sa vlani prepadol do straty
Slováci sa zbierajú pre Machalu: Chcú ho poslať do vesmíru, aby skontroloval, či je Zem guľatá
Copyright© 2024 by Startitup, s. r. o. Všetky práva vyhradené







